Что такое трипаносомоз?
Трипаносомоз — это заболевание, обычно относящееся к африканскому трипаносомозу человека. Часто приписывают синоним африканской сонной болезни. Это инфекционное заболевание вызывается паразитами Trypanosoma brucei gambiense или Trypanosoma brucei rhodesiense, а переносчиками паразитов является муха цеце. Это заболевание отличается от болезни Шагаса или американского трипаносомоза, который вызывается Trypanosoma cruzi и передается через насекомых-переносчиков хищнец. Оба заболевания имеют уникальные эпидемиологические и клинические характеристики.
Причины
Африканский трипаносомоз вызывается паразитом Trypanosoma brucei подвида Trypanosoma brucei gambiense или Trypanosoma brucei rhodesiense, переносимыми мухой цеце. Трипаносома — многоклеточное паразитическое простейшее со сложным жизненным циклом. В совокупности Trypanosoma brucei передается членистоногими-переносчиками и млекопитающим-хозяевам. Когда он проявляется клиническим заболеванием у животных, его называют «нагана», что имеет серьезные последствия для сельского хозяйства. Американский трипаносомоз, называемый болезнью Шагаса, вызывается простейшими Trypanosoma cruzi и передается через виды Triatoma (триатомы) семейства Reduviidae (хищнецы).
Признаки и симптомы
Клиническое заболевание имеет 2 стадии. Для них характерны ранняя/первая стадия гемолимфатии и поздняя/вторая стадия менингоэнцефалита с поражением центральной нервной системы (ЦНС).
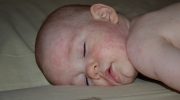
Самым ранним проявлением заболевания является кожный шанкр в месте инокуляции. Однако это случается редко у пациентов с T. brucei gambiense и нечасто (19%) у пациентов, инфицированных T. brucei rhodesiense. После этого развиваются системные симптомы:
- перемежающаяся лихорадка;
- головная боль;
- зуд и лимфаденопатия.
Лимфаденопатия может быть особенно заметной в заднем треугольнике шеи и получила эпоним «признак Уинтерботтома». Лихорадка часто сохраняется от дня до недели и разделена афебрильными интервалами от дней до месяцев. Волнообразная лихорадка отражает размножение паразитов в крови. Реже гепатоспленомегалия может возникать на ранней стадии. На поздней/второй стадии симптомы со стороны ЦНС проявляются в виде нарушений сна или нервно-психических расстройств. Нарушение сна — наиболее частый симптом второй стадии, и именно отсюда и был придан термин «африканская сонная болезнь». Проблемы со сном далее описываются как нарушение регуляции циклов сна/бодрствования и фрагментация сна. Ранее сообщалось об инверсии режима сна. Дополнительные симптомы включают:
- тремор;
- слабость;
- паралич;
- дискинезию;
- хорея-атетоз.
Может наблюдаться паркинсоническая гипертония и аномальные рефлексы. Могут присутствовать психические изменения, такие как агрессия, апатия, психоз или раздражительность. Могут быть вовлечены другие системы органов.
Щитовидная железа и кора надпочечников могут иметь гиперфункцию или гипофункцию. Оба они более выражены при инфекциях, вызванных T. brucei rhodesiense.
Клиническая конечная точка для любой подгруппы T. brucei приводит к коме и смерти при отсутствии лечения. Смерть наступает быстрее при заражении T. brucei rhodesiense, которое часто происходит в течение недель или месяцев, а при заражении T. brucei gambiense в среднем через 3 года после заражения.
Болезнь Шагаса имеет острую, неопределенную и хроническую стадии. Остро инфицированные пациенты часто протекают бессимптомно или имеют легкое неспецифическое лихорадочное заболевание. Симптомы могут включать:
- лихорадку;
- озноб;
- желудочно-кишечные проявления;
- лимфаденопатию;
- гепатоспленомегалию;
- или сочетание кожных проявлений.
Шагома — это затвердевшая, эритематозная папула или узелок, возникающий на месте инокуляции. Она может появиться через несколько недель после заражения. Симптомы Романа классически ассоциируются с острой болезнью Шагаса и характеризуются отеком век и периокулярным отеком, вторичным по отношению к отложениям паразитов в конъюнктиве. Шизотрипаниды — это термин, используемый для описания диффузной болезненной сыпи во время острой инфекции и наблюдается у меньшинства инфицированных пациентов.
Неопределенная стадия болезни Шагаса отражает иммунный ответ хозяина и уменьшение количества паразитов. Это происходит через несколько месяцев после заражения. В настоящее время антитела к T. cruzi присутствуют, а клиническая картина заболевания отсутствует.
Самая разрушительная стадия болезни — хроническая. До трети пациентов с болезнью Шагаса прогрессируют до этой стадии, которая проявляется нарушениями сердечной проводимости, дилатационной застойной сердечной недостаточностью или тромбоэмболическими явлениями. Сердечная недостаточность часто проявляется аневризматической дилатацией левого желудочка, а наиболее распространенным дефектом проводимости является блокада правой ножки пучка Гиса с передней фасцикулярной блокадой или без нее. Поражение желудочно-кишечного тракта (ЖКТ) встречается у меньшинства инфицированных пациентов, однако из них наиболее частым проявлением является мегаэзофагус в результате повреждения вегетативных ганглиев с последующей ахалазией, дисфагией, потерей веса или повторной аспирацией. Наконец, у пациентов с этим заболеванием со сниженным иммунитетом может возникнуть реактивация. Она может проявляться как рецидив лихорадки и кожных эритематозных узелков или бляшек наряду с менингоэнцефалитом.
Эпидемиология
Африканский трипаносомоз наблюдается примерно в 30 странах Африки к югу от Сахары, и в 2012 году было зарегистрировано более 7000 случаев этого заболевания. Паразит и последующее заболевание классически делятся на западноафриканский и восточноафриканский варианты. Западно-центральноафриканская форма вызывается T. brucei gambiense. Это часто хроническое и смертельное заболевание при отсутствии лечения. Восточно-южноафриканская инфекция вызывается T. brucei rhodesiense и помимо человека, часто встречается у крупного рогатого скота. Подавляющее большинство зарегистрированных инфекций вызвано T. brucei gambiense. Географическое распределение демонстрирует прогрессирующее перекрытие по мере перемещения T. brucei rhodesiense на северо-запад.
Исторически сложилось, что Т. brucei был ответственен за эпидемии в конце 1800-х и начале 1900-х годов, убив около миллиона человек. Колониальные страны начали раннюю борьбу с переносчиками болезней и эпидемиологический надзор, и в 1960-х годах болезнь была почти полностью ликвидирована. Государственная независимость и прекращение эпиднадзора привели к рецидиву, пик заболеваемости пришелся на конец 1990-х годов.
Африканский трипаносомоз в основном встречается в сельских общинах и бедных районах. Это распределение занижено, и, хотя Всемирная организация здравоохранения (ВОЗ) попыталась восстановить программы контроля, не все страны сообщают о заболеваниях или принимают эти меры.
Хроническая форма африканского трипаносомоза, вызванная T. brucei gambiense, редко встречается у краткосрочных туристов и посетителей, но встречается у беженцев и иммигрантов. Напротив, T. brucei rhodesiense был замечен у туристов в Восточной Африке, в основном в Танзании.
В долгосрочном плане цель ВОЗ — ликвидировать африканский трипаносомоз к 2020 году. В попытке сделать это реальностью внедряются многочисленные методы скрининга, планы терапевтического обеспечения и программы отчетности о заболеваниях.
Болезнь Шагаса, хотя первоначально была обнаружена в 1909 году, по-прежнему является основной причиной заболеваемости и смертности в эндемичных странах Центральной и Южной Америки, и считается, что во всем мире инфицированы до 10 миллионов человек.
Патофизиология
Муха цеце переносит трипаносомы в средней кишке после приема пищи с кровью. Эти простейшие затем мигрируют в слюнные железы мухи, где могут передаваться во время следующего кормления. После инокуляции внутри хозяина паразит может свободно жить в кровотоке и уклоняться от защиты хозяина млекопитающего с помощью вариабельных поверхностных гликопротеинов (ВПГ). Тонкая форма секретирует ВПГ, специфичный для стадии кровотока, чтобы уклоняться от иммунной системы хозяина, и именно в этой форме организм размножается. По мере увеличения популяции паразита возникает морфологическая коренастая форма с остановкой деления. Именно на этой стадии он может передаваться другой мухе цеце от млекопитающего-хозяина. В новом переносчике мухи цеце и после этой короткой стадии организм переходит в проциклическую форму, в результате чего ВПГ теряется, и паразит снова устанавливается в средней кишке мухи. Деление клеток снова останавливается, и они мигрируют в слюнные железы в виде эпимастигот. Они переходят из другой стадии пролиферации в непролиферативную форму, когда они снова приобретают ВПГ и теперь способны повторно заразить новое млекопитающее при следующем приёме крови.
Хищнецы — это прежде всего ночные насекомыми. Во время кормления насекомое откладывает фекалии через трещины на коже, содержащие T. cruzi. Менее распространенные способы передачи включают прием зараженной пищи, врожденную передачу или передачу через зараженную кровь или ткани. Поскольку переливание крови исторически было основным путем заражения в эндемичных районах, донорская кровь часто подвергается регулярной проверке.
Диагностика
Ведение трипаносомоза осуществляется в три этапа.
- Скрининг для выявления потенциальной инфекции. Он включает проведение серологических тестов (имеющихся только в отношении T.b. gambiense) и проверку на наличие клинических признаков – в основном опухших шейных желез.
- Диагностика для установления наличия или отсутствия паразита.
- Определение стадии болезни. Для этого проводится клиническое обследование и в некоторых случаях исследование спинномозговой жидкости, получаемой с помощью люмбальной пункции.
Чтобы избежать сложных, тяжелых и рискованных лечебных процедур диагноз должен быть поставлен как можно раньше и до наступления неврологической стадии.
Длительная, относительно бессимптомная первая стадия сонной болезни, вызванной T. b. gambiense, является одной из причин, по которой рекомендуется проводить всесторонний активный скрининг подвергающегося риску населения с целью выявления пациентов на ранней стадии заболевания и ограничения дальнейшей передачи инфекции благодаря тому, что эти пациенты прекращают выступать в качестве резервуара. Для проведения такого всестороннего скрининга необходимы крупные инвестиции в кадровые и материальные ресурсы. В Африке эти ресурсы часто весьма скудны, особенно в отдаленных районах, где эта болезнь наиболее распространена. В результате многие инфицированные люди умирают до постановки диагноза и получения лечения.
Лечение
Лечение Trypanosoma brucei gambiense и T. brucei rhodesiense отличается, и, кроме того, терапия зависит от стадии инфекции.
При первой стадии заболевания, вызванного T. brucei gambiense, пентамидин является терапией первой линии. Путь введения: внутримышечно в течение одной недели или внутривенно с физиологическим раствором в течение 2 часов. Три инъекции по сравнению с длительной терапией могут быть одинаково эффективными. Как только обнаруживается поражение спинномозговой жидкости, пентамидин перестает действовать. Побочные эффекты пентамидина включают реакции в месте инъекции, боль в животе и гипогликемию. Более серьезные побочные эффекты, наблюдаемые при применении пентамидина при лечении других заболеваний, включают лейкопению, тромбоцитопению, гиперкалиемию и удлинение интервала QT.
Заболевание второй стадии, вызываемое T. brucei gambiense, включает эфлорнитин или меларсопрол. Было показано, что эфлорнитин превосходит меларсопрол в снижении смертности и, следовательно, является предпочтительным лекарством для лечения второй стадии заболевания. Комбинация нифуртимокса и эфлорнитина снижает дозировку и стоимость терапии. Побочные реакции аналогичны эфлорнитину и включают панцитопению, расстройство желудочно-кишечного тракта и судороги.
Первая стадия заболевания, вызванного T. brucei rhodesiense, лечится сурамином. Хотя сурамин также эффективен при заболеваниях, вызываемых T. brucei gambiense, высокая распространенность онхоцеркоза (речная слепота) в этих регионах и риск тяжелой аллергической реакции на сурамин запрещают ее использование в Западной и Центральной Африке. Для первой стадии болезни, вызванной T. brucei rhodesiense сурамин используется в течение до 30 дней. Примечательно, что это лекарство быстро разлагается в воздухе, и его необходимо вводить сразу после разбавления дистиллированной водой. Побочные реакции на сурамин включают реакции гиперчувствительности, нефротоксичность, периферическую нейропатию, токсичность для костного мозга и последующий агранулоцитоз и/или тромбоцитопению.
Вторую стадию болезни, вызванной T. brucei rhodesiense можно лечить меларсопролом. Побочные реакции могут быть тяжелыми, включая энцефалопатический синдром, у 8% пациентов. В этом случае используется дексаметазон и диазепам. Кожные реакции, включая зуд и пятнисто-папулезную сыпь проявляются часто, а буллезные поражения возникают редко. Могут возникнуть моторные и сенсорные нейропатии.
Лечение болезни Шагаса уникально тем, что используются 2 нитрогетероциклических соединения. Это бензнидазол и нифуртимокс, причем первый предпочтительнее из-за его благоприятного профиля побочных эффектов. Дозировка бензнидазола составляет 5 мг/кг в день в течение 60 дней, нифуртимокс назначают от 8 до 10 мг/кг в день для взрослых, 12,5 мг/кг в день для подростков и от 15 до 20 мг/кг в день для детей. Все продолжительностью от 90 до 120 дней. Побочные эффекты бензнидазола включают светочувствительность, тяжелый эксфолиативный дерматит, периферическую нейропатию и угнетение костного мозга. Это требует полной метаболической панели, панели функции печени и общего анализа крови, причем последний повторяется каждые две недели во время лечения. Побочные эффекты нифуртимокса включают расстройство желудочно-кишечного тракта, периферическую нейропатию и расстройства настроения. Полный анализ крови, печеночная функциональная панель и полная метаболическая панель должны быть получены с оценкой периферической нейропатии каждые 2 недели во время лечения.
Прогноз
Прогноз нелеченого трипаносомоза мрачный, смерть остается неизменной. Раннее лечение резко снизило уровень смертности, но промедление с диагностикой может быть фатальным. Когда меларсопрол был единственным вариантом лечения, смертность была выше: от 4% до 12% смертей приходилось на одно только лечение.
Среди пациентов с болезнью Шагаса кардиомиопатия может возникать у трети инфицированных пациентов и иметь разрушительные последствия. Мегаэзофагус встречается реже, но, если присутствует, вносит огромный вклад в заболеваемость. Лечение острого заболевания может привести к излечению до 80%, а лечение бензнидазолом может снизить частоту отклонений ЭКГ и серологических титров. Успех лечения пациентов с хронической стадией болезни Шагаса сомнителен.